Ingeniería Genética
¿Que es?
biotecnología que se basa en la manipulación
genética de organismos con un propósito predeterminado, aprovechable por el hombre:
se trata de aislar el gen que produce la sustancia e introducirlo en otro ser vivo que sea
más sencillo de manipular. Lo que se consigue es modificar las características
hereditarias de un organismo de una forma dirigida por el hombre, alterando su material
genético.
El proceso puede utilizarse ya en bacterias y en células eucariotas vegetales o animales.
Una vez adicionada o modificada la carga cromosómica, el organismo en cuestión
sintetiza la proteína deseada y el aumento del rendimiento de la producción
puede obtenerse mediante el aumento en la población portadora. Las bases de la
ingeniería genética han consistido en resolver el problema de la localización e inserción
de genes y la multiplicación redituable de las factorías logradas.
las técnicas utilizadas por la ingeniería genética son varias, y cada una atiende un
aspecto de la tarea de preparación y solución de los problemas específicos de esta
tecnología, sin embargo muchas de ellas ha tenido éxito en otros campos tecnocientíficos.
1.1 La gel-Electroforesis
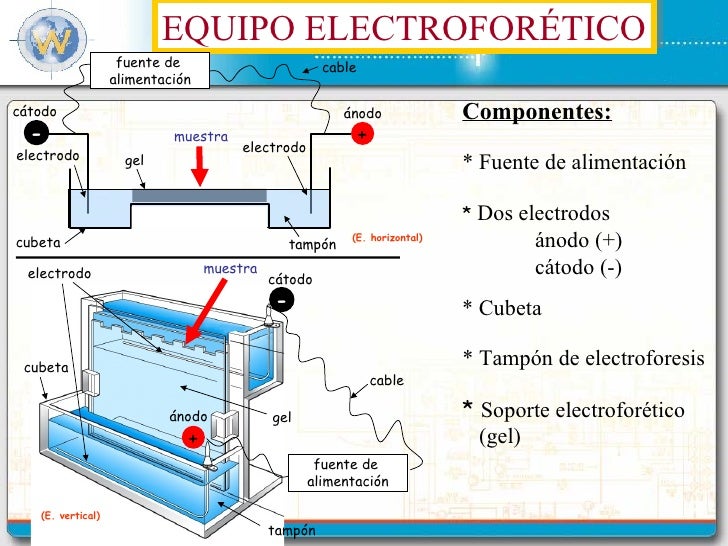 Esta técnica permite tratar con bajas concentraciones de ADN, de hasta 100
nanogramos y su objetivo es mediante un método bioquímico, basado en reacciones
enzimáticas poder analizar de forma rápida la variabilidad genética que se puede
encontrar en una población
Esta técnica permite tratar con bajas concentraciones de ADN, de hasta 100
nanogramos y su objetivo es mediante un método bioquímico, basado en reacciones
enzimáticas poder analizar de forma rápida la variabilidad genética que se puede
encontrar en una población
determinada. La práctica de la electroforesis de enzimas en gel aplica la afirmación teórica de que el producto de un gen, será una proteína que tendrá actividad enzimática. El método consiste en obtener las enzimas del material que se desea conocer empaparlas en papel secante, e introducir estos papeles en el gel. Posteriormente habrá que someterlo a la electroforesis para lograr la migración de las proteínas que será diferencial dependiendo de la carga eléctrica de la proteína.
1.2 ADN recombinate
Esta técnica permite aislar un gen de un organismo, para su posterior manipulación e inserción en otro diferente. De esta manera podemos hacer que un organismo animal, vegetal, bacteria, hongo, o un virus, produzcan una proteína que le sea totalmente extraña. Se emplea normalmente para la producción de proteínas en gran escala, ya que podemos hacer que una bacteria produzca una proteína humana y lograr una superproducción De una manera muy simple podemos decir que "cortamos" un gen humano y se lo "pegamos" al ADN de una bacteria; si por ejemplo es el gen que regula la fabricación de insulina, lo que haríamos al ponérselo a una bacteria es "obligar" a ésta a que fabrique la insulina. Como las bacterias se multiplican muy rápidamente y pueden expresar grandes cantidades de proteínas, es posible lograr una sobreproducción de la proteína deseada. A esto justamente se dedica la biotecnología, es decir a la utilización de organismos vivos o de sus productos con fines prácticos.
El desarrollo de la tecnología del ADN recombinante fue posible gracias a varias líneas de investigación:
el conocimiento de las enzimas de restricción
-- la replicación y reparación de ADN
-- la replicación de virus y plásmidos
-- la síntesis química de secuencias de nucleótidos.

1.3 Vectores
Cuando se pretende que las “factorías” biotecnológicas (o una célula) produzca un material específico, debe dársele la orden específica, esto es proveerle de los genes necesarios. Para ello se debe agregar a su ADN natural un complemento génico (previamente determinado y aislado), lo que es posible por medio de un vector o transportador. Estos vectores permiten obtener múltiples copias de un trozo específico de ADN, lo que proporciona una gran cantidad de material fiable con el que trabajar. El proceso de transformación de una porción de ADN en un vector se denomina clonación.

1.4 Técnica De la PCR
También existen métodos para amplificar una determinada secuencia o fragmento de ADN. La más conocida es la técnica de la reacción en cadena de la polimerasa PCR. Así se consigue multiplicar un determinado fragmento de ADN millones de veces para poder tener una cantidad suficiente para estudiarlo. Sin esta técnica serían imposibles los estudios de ADN para el reconocimiento de la paternidad o en caso de delito, pues la cantidad de ADN presente en las células es tan pequeña, del orden de picogramos , que se necesitaría una gran cantidad de material celular para tener una cantidad apreciable de ADN. Por su lado, para la amplificación del gen, los biotecnólogos cuentan con dos procedimientos que son hoy en día los más usados:
-El logrado por E.M. Southern en 1975, comienza con la separación del ADN digerido por enzimas de restricción , los fragmentos resultantes se separan por tamaño mediante la gel-electroforesis y luego se transfieren a un filtro. El ADN adherido se desnaturaliza (sometiendo las doble cadenas de ADN a alta temperatura lo que rompe los puentes hidrogenados que las mantienen unidas) y se hibrida (o deja que se ligue) exponiéndolo a sondas radiativas 7 , lo que permitirá detectar por rayos X los fragmentos de interés para su purificación y duplicación en procedimientos de estudios o manipulación.
-En 1988 estuvo disponible un nuevo método la reacción en cadena de la polimerasa (PCR), ideada en 1983 por Kary Mullis. Éste permite mecánicamente, la amplificación de genes en grandes cantidades a partir de muy poco ADN. El sistema implica la adición de un cebador corto (un oligonucleótido) en cada extremo de la secuencia elegida de ADN, separando las dos cadenas de la doble hélice por calentamiento y exponiéndolas a un ADN polimerasa que reconoce a los cebadores dispuestos a cierta distancia entre sí en lados opuestos de la cadena y duplica el número de cadenas de ADN en la muestra. Esta enzima es obtenido a partir de una purificación de una bacteria que prospera en las elevadas temperaturas de las aguas termales y que no se desnaturaliza por temperatura cuando el ADN seleccionado lo es. De este modo en la PCR, ambas cadenas de ADN se copian simultáneamente y si el procedimiento se repite unas veinte veces, se obtendrán un millón de copias a partir de un solo fragmento original.

1.5 Biochips
Los últimos avances en biología molecular, especialmente en genética y genómica, ha llevado a la aparición de numerosas técnicas experimentales. Entre estas herramientas destacan los biochips, que permiten conocer mutaciones genéticas en los pacientes. De este modo, la comunidad científica dispondrá del material adecuado para afrontar el reto que se le plantea tras haberse completado la primera fase del Proyecto Genoma: estudiar la función de los genes, las diferencias genéticas individuales y su incidencia en el desarrollo de las enfermedades. Estos biochips son dispositivos miniaturizados en los que se pueden depositar decenas de miles de sondas de material genético conocido en posiciones predeterminadas, constituyendo una matriz. En los estudios, se ponen en contacto los biochips con material genético marcado, obtenido de una muestra de un paciente o experimento. En ese momento, generan un patrón de señales particular cuya lectura se realiza con un escáner y posteriormente se interpretan con un ordenador.

1.1 La gel-Electroforesis
El problema de encontrar, separar y analizar los fragmentos de ADN correspondiente a
un gen específico se logró resolver sobre la base de los estudios de Linus Pauling que
demostraron que las moléculas migran a distintas velocidades hacia los polos
magnéticos: se colocan porciones de ADN sobre un gel de agarosa2 y se les permite que
migren hacia los polos del campo magnético. La senda seguida por el ADN y las
manchas formadas se tornan visibles en una película de rayos X como el código de
bandas de un producto en el supermercado.

determinada. La práctica de la electroforesis de enzimas en gel aplica la afirmación teórica de que el producto de un gen, será una proteína que tendrá actividad enzimática. El método consiste en obtener las enzimas del material que se desea conocer empaparlas en papel secante, e introducir estos papeles en el gel. Posteriormente habrá que someterlo a la electroforesis para lograr la migración de las proteínas que será diferencial dependiendo de la carga eléctrica de la proteína.
1.2 ADN recombinate
Esta técnica permite aislar un gen de un organismo, para su posterior manipulación e inserción en otro diferente. De esta manera podemos hacer que un organismo animal, vegetal, bacteria, hongo, o un virus, produzcan una proteína que le sea totalmente extraña. Se emplea normalmente para la producción de proteínas en gran escala, ya que podemos hacer que una bacteria produzca una proteína humana y lograr una superproducción De una manera muy simple podemos decir que "cortamos" un gen humano y se lo "pegamos" al ADN de una bacteria; si por ejemplo es el gen que regula la fabricación de insulina, lo que haríamos al ponérselo a una bacteria es "obligar" a ésta a que fabrique la insulina. Como las bacterias se multiplican muy rápidamente y pueden expresar grandes cantidades de proteínas, es posible lograr una sobreproducción de la proteína deseada. A esto justamente se dedica la biotecnología, es decir a la utilización de organismos vivos o de sus productos con fines prácticos.
El desarrollo de la tecnología del ADN recombinante fue posible gracias a varias líneas de investigación:
el conocimiento de las enzimas de restricción
-- la replicación y reparación de ADN
-- la replicación de virus y plásmidos
-- la síntesis química de secuencias de nucleótidos.

1.3 Vectores
Cuando se pretende que las “factorías” biotecnológicas (o una célula) produzca un material específico, debe dársele la orden específica, esto es proveerle de los genes necesarios. Para ello se debe agregar a su ADN natural un complemento génico (previamente determinado y aislado), lo que es posible por medio de un vector o transportador. Estos vectores permiten obtener múltiples copias de un trozo específico de ADN, lo que proporciona una gran cantidad de material fiable con el que trabajar. El proceso de transformación de una porción de ADN en un vector se denomina clonación.
1.4 Técnica De la PCR
También existen métodos para amplificar una determinada secuencia o fragmento de ADN. La más conocida es la técnica de la reacción en cadena de la polimerasa PCR. Así se consigue multiplicar un determinado fragmento de ADN millones de veces para poder tener una cantidad suficiente para estudiarlo. Sin esta técnica serían imposibles los estudios de ADN para el reconocimiento de la paternidad o en caso de delito, pues la cantidad de ADN presente en las células es tan pequeña, del orden de picogramos , que se necesitaría una gran cantidad de material celular para tener una cantidad apreciable de ADN. Por su lado, para la amplificación del gen, los biotecnólogos cuentan con dos procedimientos que son hoy en día los más usados:
-El logrado por E.M. Southern en 1975, comienza con la separación del ADN digerido por enzimas de restricción , los fragmentos resultantes se separan por tamaño mediante la gel-electroforesis y luego se transfieren a un filtro. El ADN adherido se desnaturaliza (sometiendo las doble cadenas de ADN a alta temperatura lo que rompe los puentes hidrogenados que las mantienen unidas) y se hibrida (o deja que se ligue) exponiéndolo a sondas radiativas 7 , lo que permitirá detectar por rayos X los fragmentos de interés para su purificación y duplicación en procedimientos de estudios o manipulación.
-En 1988 estuvo disponible un nuevo método la reacción en cadena de la polimerasa (PCR), ideada en 1983 por Kary Mullis. Éste permite mecánicamente, la amplificación de genes en grandes cantidades a partir de muy poco ADN. El sistema implica la adición de un cebador corto (un oligonucleótido) en cada extremo de la secuencia elegida de ADN, separando las dos cadenas de la doble hélice por calentamiento y exponiéndolas a un ADN polimerasa que reconoce a los cebadores dispuestos a cierta distancia entre sí en lados opuestos de la cadena y duplica el número de cadenas de ADN en la muestra. Esta enzima es obtenido a partir de una purificación de una bacteria que prospera en las elevadas temperaturas de las aguas termales y que no se desnaturaliza por temperatura cuando el ADN seleccionado lo es. De este modo en la PCR, ambas cadenas de ADN se copian simultáneamente y si el procedimiento se repite unas veinte veces, se obtendrán un millón de copias a partir de un solo fragmento original.
1.5 Biochips
Los últimos avances en biología molecular, especialmente en genética y genómica, ha llevado a la aparición de numerosas técnicas experimentales. Entre estas herramientas destacan los biochips, que permiten conocer mutaciones genéticas en los pacientes. De este modo, la comunidad científica dispondrá del material adecuado para afrontar el reto que se le plantea tras haberse completado la primera fase del Proyecto Genoma: estudiar la función de los genes, las diferencias genéticas individuales y su incidencia en el desarrollo de las enfermedades. Estos biochips son dispositivos miniaturizados en los que se pueden depositar decenas de miles de sondas de material genético conocido en posiciones predeterminadas, constituyendo una matriz. En los estudios, se ponen en contacto los biochips con material genético marcado, obtenido de una muestra de un paciente o experimento. En ese momento, generan un patrón de señales particular cuya lectura se realiza con un escáner y posteriormente se interpretan con un ordenador.
APLICACIONES DE LA INGENIERÍA GENÉTICA
La aplicación de las técnicas utilizadas por la Ingeniería Genética ha permitido elevar la
calidad de vida del ser humano. Los organismos transgénicos han pasado a ocupar una
posición central en la biotecnología moderna, porque permiten hacer modificaciones
muy específicas del genoma que vale la pena analizar con detalle, debido a sus
importantes aplicaciones presentes y futuras.
2.1 Obtención de proteínas de interés medico y económico
➧antibióticos
➧enzimas
➧hormonas: insulina, hormona del crecimiento, eritropoyetina…
➧vacunas
➧proteínas sanguíneas: seroalbúmina, factores de coagulación…
2.2 Mejora genética de vegetales y animales para obtener una mayor producción y mejor calidad nutricional
Con el mejoramiento genético de los vegetales, se espera conseguir:
➧Mayor adaptación a diversos ambientes.
➧Mejores características agronómicas (resistencia, desgrane, buena cobertura, etc.).
➧Resistencia a plagas y enfermedades.
➧Resistencia a la sequía, temperaturas bajas o altas, etc.
Para incrementar la calidad de los productos se persigue:
➧Alto valor nutritivo (proteínas y vitaminas).
➧Mayor coloración, sabor y/o tamaño de los frutos.
➧Resistencia al transporte y almacenamiento.
➧Reducción de la cantidad de ciertas sustancias indeseables en los productos, etc.
2.3 Obtención de plantas clonicas para cultivos
La clonación de vegetales en un proceso técnicamente sencillo debido a que los
vegetales tienen la capacidad de generar (en condiciones muy especiales) todo un
organismo completo a partir de pocas células completamente diferenciadas. Los pasos a
seguir para la obtención de plantas clónicas son:
➧Se aíslan una o diversas células de cualquier parte de la planta (especialmente las
hojas).
➧Se cultivan en el laboratorio las células hasta que se desarrolla una planta adulta.
2.4 Obtención de ``bioinsecticiadas``, animales y plantas capaces de destruir a otros seres vivos que se alimentan de los cultivos
2.5 Obtención de animales y vegetales transgenicos
➤ Animales
➧obtención de órganos animales (cerdos) con genes humanos para no ser rechazados
en trasplantes.
➧ animales con carnes y huevos con menos colesterol y grasas
➧ pollos sin plumas.
➤vegetales
➧resistentes a insectos: maíz y algodón con un gen que produce
una toxina para orugas y escarabajos ➧resistentes a herbicidas: soja, algodón, maíz, resisten a altas
concentraciones de herbicidas que se echan en los campos para
erradicar malas hierbas
➧resistentes a condiciones ambientales: frío, sequía, alta
salinidad, etc.
2.6 Biodegradacion de residuos
Clonación de genes bacterianos productores de enzimas que degradan sustancias tóxicas
o contaminantes (tratamiento de aguas residuales, transformación de desechos
domésticos, degradación de residuos peligrosos y fabricación de compuestos
biodegradables...), regeneran suelos y aguas contaminadas, etc..
2.7 secuenciacion de ADN
Secuenciar ADNs es analizar la composición de un fragmento de ADN para saber qué
genes tiene y qué producen esos genes; esto es lo que se está haciendo en el Proyecto
Genoma Humano.
2.8 Terapias Genéticas
Consisten en manipular genéticamente células enfermas
para que ellas mismas puedan producir las proteínas cuya
falta o mal funcionamiento provoca la enfermedad: con la
ayuda de un vector adecuado se introduce el gen correcto y
se integra en el ADN de la célula enferma
Las enfermedades hereditarias provocadas por la carencia de una enzima o proteína son
las más idóneas para estos tratamientos. Pero también aquellas en las que no importa
demasiado el control preciso y riguroso de los niveles de la proteína cuya producción se
pretende inducir mediante manipulación genética. Se trata normalmente de
enfermedades monogénicas, originadas por la alteración de un único gen recesivo
anómalo y en las que basta la mera presencia del producto génico para corregir el
defecto.
Una de las principales vías de investigación actuales es la de marcar genéticamente a las
células tumorales de un cáncer para que el organismo las reconozca como extrañas y
pueda luchar contra ellas.
➧Cáncer: melanoma, riñón, ovario, colon, leucemia, pulmón, hígado, próstata...
➧Fibrosis quística
➧Hipercolesterolemia
➧Hemofilia
➧Artritis reumática
➧Diabetes
➧SIDA
Ventajas e inconveniente
3.1 Ventajas
El principal avance de la Ingeniería Genética consiste en la capacidad para crear
especies nuevas a partir de la combinación de genes de varias existentes, combinando
también por lo tanto sus características. Cultivos con genes de insectos para que
desarrollen toxinas insecticidas o tomates con genes de pez para retrasar la
marchitación, han dejado hace tiempo de ser ciencia-ficción para constituir una realidad
en nuestros días.
Permitir el cultivo de hortalizas en áreas desérticas hasta ahora estériles o aumentar el
tamaño de los frutos cultivados son algunos de los adelantos que la utilización de este
tipo de técnicas puede aportar a la Humanidad, con los logros que supone hacia la
erradicación del hambre en el Mundo. Lo que no se ha definido todavía es cómo
compatibilizar estos objetivos con los intereses económicos de las empresas de
biotecnología que los desarrollan.
➧Gracias a la ingeniería genética, los científicos pueden hacer ciertas
combinaciones entre genes de diferentes especies, para así solucionar problemas
y mejorar el rendimiento económico-comercial de las explotaciones.
➧Se pueden buscar curas a enfermedades genéticas para que las nuevas
generaciones nazcan más sanas.
➧Al tomate por ejemplo se le ponen
genes antisentido (en sentido inverso a un
gen concreto) para así retrasar el proceso de
reblandecimiento.
➧Gracias a esto, la ciencia ha conseguido que
se cultiven plantas con mayor tolerancia a la sequía o protegidos frente a virus.
➧En algunos cultivos, se han puesto genes de bacterias para que desarrollen
proteínas insecticidas y reducir el empleo de insecticidas.
➧También se pueden insertar genes humanos responsables de la producción de
insulina en células bacterianas para obtener insulina de gran calidad a bajo coste.
Estas células pueden producir mucha cantidad ya que se reproducen a una gran
velocidad.
3.2 Inconvenientes
Los expertos advierten que detrás de estas mejoras y nuevas aplicaciones se esconden
también riesgos y peligros de notable importancia.
Como sucede siempre, las desventajas provienen o pueden proceder del mal uso de las
técnicas mencionadas, lo cual es motivo de preocupación por los riesgos e
implicaciones que pueden derivarse. A ello ha dado respuesta el Comité Internacional
de Bioética de la Unesco fijando unos objetivos que pueden concretarse en dos:
a) evitar aspectos del progreso que atenten contra la dignidad humana
b) que las posibilidades científicas no generen peligrosidad por falta de definiciones
éticas.
Los criterios para evitar dichos inconvenientes establecen una serie de limitaciones por
motivos ecológicos, sanitarios, morales, sociales, políticos... y en concreto se trata sobre
todo de la salvaguarda de la dignidad y los derechos humanos, de no dar posibilidad a la
discriminación social ni ideológica de evitar desastres ecológicos y de impedir el
desarrollo o aparición de enfermedades que pudieran ser incontrolables.
➧Uno de estos peligros es el hecho de que detrás de los proyectos de
manipulación genética están las compañías multinacionales muy preocupadas
por el interés económico.
➧También pueden “contaminar” otras plantas no transgénicas.
➧Pueden llegar a ser cancerígenas en el caso de ser consumidos por sujetos
proclives o en un estado inmunológico deficiente. No obstante esto es una
hipótesis pero que muchos médicos que están en contra de los
alimentos transgénicos lo afirman.
➧Puede producir alergias, algo que preocupa mucho a los productores de estos
alimentos. Puede ser debida al material genético transferido, a la formación
inesperada de un alérgeno o a la falta de información sobre la proteína que
codifica el gen insertado.

